Апластическая анемия
Содержание:
- От каких болезней следует отличать апластическую анемию
- Лечение
- Возможные осложнения
- Осложнения
- Клиническое течение у детей
- Апластическая анемия – что это такое?
- Диагностика
- Симптомы апластической анемии
- Течение болезни
- Апластическая анемия – механизм развития
- Классификация анемий
- Патогенез заболевания
- Апластическая анемия у детей
От каких болезней следует отличать апластическую анемию
Угнетение костного мозга обнаруживается не только при апластической анемии, но и при других заболеваниях. Правильно определить диагноз помогает сопоставление симптомов и результатов обследования.
- Лейкозы — чаще обнаруживается увеличение селезенки, в костном мозге много бластных клеток предшественников лейкоцитов.
- Агранулоцитозы — не вызывают анемию и снижение тромбоцитов.
- Болезни с увеличением печени и селезенки — гепатиты, цирроз, тромбофлебит селезеночной вены — выявляется желтушность кожи и склер, нарушение печеночных проб.
- Редкое заболевание, пароксизмальная ночная гемоглобинурия (ПНГ) возникает в возрасте от 30 до 35 лет. Вызвана отсутствием определенных видов белков. Клетки, в которых при проведении иммунотипирования не находят этих структур, называют ПНГ клонами. Клинически болезнь проявляется внутрисосудистым гемолизом с кровью в моче, снижением гемоглобина, повышением билирубина, недостаточностью клеток костного мозга. У 40% больных наблюдается тромбоз крупных вен и артерий. Это и является причиной смерти.
Лечение
Лечение апластической анемии зависит от главного фактора, который предположительно стал причиной развития патологического процесса.
Если заболевание выявлено впервые, больной обязательно подлежит госпитализации в стационар, отделение гематологии. Только в условиях лечебного учреждения можно корректно подобрать необходимый для лечения лекарственный препарат, а также определиться с его дозировкой.
Основными методиками коррекции и лечения апластической анемии у детей и взрослого являются:
- трансфузионные методы (переливание крови);
- трансплантационные методы;
- медикаментозные методы.
Трансфузия
Трансфузионный терапевтический метод предполагает переливание больному цельной, эритроцитарной или тромбоцитарной массы, а также гранулоцитов крови. Препараты крови, использующие в трансфузии, готовятся на станциях переливания из донорской крови. Данный метод трансфузии — временный, так как он позволяет только восполнить дефицит клеток крови, но нарушения в костном мозге при этом не ликвидируются. Еще одним минусом трансфузии является то, что при диагностировании аутоиммунных форм апластической анемии применять его нельзя.

Если операции по переливанию крови больному делают довольно часто, это может привести к накоплению в его организме излишков железа, которые откладываются в печени и селезенке. Поэтому такой категории пациентов включают в терапию лекарственные препараты, влияющие на выведение железа из крови.
Трансплантация
Наиболее эффективным методом лечения апластической анемии принято считать трансплантационный, при котором происходит пересадка костного мозга человека. Вероятность успеха операции по пересадке костного мозга зависит от возраста больного, процент успешного исхода тем выше, чем моложе пациент. В качестве донора может выступить один из ближайших родственников, имеющий такую же группу крови, что и больной. Для этого необходимо провести исследование на индивидуальную совместимость их групп крови.
Данная методика лечения требует определенной подготовки, чтобы снизить процент вероятности отторжения чужеродных тканей. Перед процедурой переливания крови отменяются, назначается проведение лучевой терапии, закрепленной в последствие курсом химиотерапевтических препаратов. Делается это с целью временного подавления иммунной системы больного, которая может спровоцировать отторжение донорских стволовых клеток. Трансплантация костного мозга при анемии – очень дорогостоящая операция, проводится только в специализированных клиниках.
Медикаменты
Медикаментозная терапия при апластической анемии у человека включает применение следующих лекарственных средств:
- иммунодепрессанты – например, циклоспорин, специфические антиглобулины. Применение этих лекарственных форм показано в тех случаях, когда невозможно провести операцию по пересадке костного мозга. Назначаются они комплексно с кортикостероидами, чтобы предупредить развитие анафилактических реакций;
- лекарственные препараты, стимулирующие процессы кроветворения – например, филграстим, лейкомакс. Назначают их только в случае диагностирования лейкопении, поскольку они активируют процессы образования гранулярных лейкоцитов;
- для лечения апластической анемии у мужчин применяют препараты, содержащие андрогены (мужские половые гормоны) – тестостерона пропионат, сустанон;
- при выраженном геморрагическом синдроме показано назначение гемостатиков – дицинон, аминокапроновая кислота;
- одним из примеров препаратов, способствующих выведению железа из крови, является десферал.
Спленэктомия
Еще один метод лечения апластических анемий — спленэктомия, другими словами операция по удалению селезенки. Частота положительного эффекта составляет 85%. В основе этого метода лечения лежит прекращение аутоиммунных процессов в организме, когда вырабатываются антитела к собственным клеткам. Его можно проводить любым пациентам, у которых отсутствуют инфекционные осложнения.
Возможные осложнения
При апластической анемии возможны следующие последствия:
- различные кровотечения – геморрагические осложнения. Самое опасное осложнение – геморрагический инсульт (определенный участок головного мозга пропитывается кровью, в результате чего гибнет);
- анемическая кома – отсутствие реакции на происходящее из-за утраты сознания, возникающее в результате поступления недостаточного количества кислорода к головному мозгу, что вызвано значительным снижением количества эритроцитов;
- при наличии хронических заболеваний ухудшается состояние внутренних органов.
- осложнения инфекционного характера – развитие заболеваний, которые вызваны различными микроорганизмами (бактерии, грибы, вирусы);
Если при данном заболевании не проводится лечение, в 90% случаев пациент умирает в течение года.
Осложнения
Основными осложнениями и непосредственной причиной смерти больных являются кровотечения и инфекционно-воспалительные процессы. Геморрагии выявляются при снижении числа тромбоцитов ниже критического уровня (20 000—30 000 в 1 мкл), могут провоцироваться даже незначительными травмами (подкожные инъекции и т. д.). Инфекции (пневмонии и др.) развиваются при достаточно длительном и выраженном (менее 500 в 1 мкл) снижении числа нейтрофилов.
Всякая лихорадка у больных Г. а., как правило, связана с наличием инфекционного очага; описано немало случаев развития у них острого лейкоза. Лейкозы на фоне гипоплазии лучевого или бензольного происхождения относятся к группе миелобластных или миеломонобластных и являются, видимо, поздним результатом лейкемогенного действия фактора, вызвавшего анемию. Значительно реже наблюдается присоединение к Г. а. пароксизмальной ночной гемоглобинурии, хотя некоторые авторы трактуют в этих случаях Гипопластическую анемию как гипопластическую стадию данной формы гемолитической анемии.
Клиническое течение у детей
Для апластической анемии все симптомы имеют прямую зависимость от вида заболевания. При анемическом состоянии Фанкони у малыша выявляются унаследованные патологические процессы костей (отсутствует первый палец на руке, отсутствие или искривление лучевых костей). К этим дефектам прибавляются сердечные, почечные отклонения, мелкие глаза.
Апластический тип анемии у ребёнка проявлен с четырёхлетнего возраста, до 4 лет апластическое анемическое состояние крови проявляется редко. У малыша болит голова, он сильно устаёт, его часто беспокоят простудные инфекционные патологии. Часто у него течёт кровь из носа.
Анемия апластическая хронизируется, иногда проявляются обострённые состояния. Смерть от апластической анемии может наступить вследствие инфекционных патологических процессов либо острой кровопотери.
При анемическом состоянии, описанном Эстреном-Дамешеком, выражены патологические изменения крови. Эпизоды встречаются редко.
Анемическое состояние крови, описанное Даймондом-Блекфеном, повреждает ростки эритроцитов. Костные и глазные патологии встречаются редко. Кровотечения не наблюдаются.
Кожа бледно-серая. Характерна ранняя гепатомегалия, спленомегалия. При исследовании крови тромбоцитные и лейкоцитные компоненты снижены только при сильно поражённой селезёнке. У больного 100 лейкоцитов на один эритроцит. Нормальное соотношение составляет 4 к 1. Хронизация патологического процесса при апластической анемии не дозволяет больному пережить двадцатилетний рубеж.
Апластическая анемия – что это такое?
Людей, которые столкнулись с проблемами кроветворения, интересует: апластическая анемия – что за болезнь? Впервые заболевание было описано в 1888 году немецким врачом-иммунологом Паулем Эрлихом. Термин появился немного позже, в 1904 г. Патология признана одним из самых тяжелых расстройств гемопоэза – процесса образования и созревания клеток крови. Длительное время данный вид анемии рассматривался, как синдром, объединяющий выраженную гипоплазию кроветворения и изменения в костном мозге. Но сегодня состояние выделяют в самостоятельную нозологическую единицу.
Для апластической анемии характерно угнетение костного мозга, который при данной патологии отказывается воспроизводить все виды клеток: эритроциты, тромбоциты, лейкоциты. В редких случаях нарушено образование лишь одних эритроцитов. Состояние определяют, как тяжелое. Заболевание с трудом поддается лечению, и больные могут умереть спустя несколько недель, если вовремя не вмешаться и не провести лечение.
Апластическая и гипопластическая анемия – разница
Иногда АА называют гипопластической. Термины можно считать практически синонимами, хотя разница между ними существует. Апластическая и гипопластическая анемия относятся к поражению костного мозга, но в последнем случае он теряет способность к самовосстановлению, все кроветворные ростки поражаются, но угнетение не столь глубоко, чем при АА. Различия обусловлены степенью поражения.
Апластическая анемия – классификация
Различают несколько видов патологии, классифицируя их в зависимости от тяжести, этиологии и прочих факторов. Так называют острую, подострую и хронические формы (болезни до 1 месяца течения, от 1 до 6 и дольше), врожденную и приобретенную анемию. По тяжести апластическая анемия делится на сверхтяжелую, тяжелую и умеренную, определить которую можно по уровню тромбоцитов и гранулоцитов в крови. В зависимости от возникновения различают несколько подвидов АА:
- идиопатическая апластическая анемия, истинные причины которой неизвестны;
- вызванная внешними агентами;
- лекарственная или медикаментозная, провокатором которой стало употребление определенных средств;
- конституциональная или анемия Фанкони, наследуется по аутосомно-рецессивному типу;
- неуточненная.
Диагностика
Изучение анамнеза заболевания — первая мера, позволяющая установить факт наличия заболевания. Врач опрашивает больного, устанавливая частоту и время появления признаков, присутствие других признаков. Имеет большое значение и анализ жизни пациента, так как можно выявить возможные причины.
При осмотре больного выявляют пониженное артериальное давление, учащённый пульс и бледный оттенок кожи. В некоторых местах на слизистых оболочках и кожных покровах могут присутствовать незначительные кровоизлияния.
Для получения полной информации о патологии прибегают к помощи инструментальных и лабораторных методов диагностики:
- Анализ крови. Наблюдается снижение уровня гемоглобина, количество тромбоцитов, лейкоцитов и эритроцитов тоже ниже нормы.
- Биохимический анализ крови. Применяется для обнаружения поражённых органов, изучают уровень глюкозы, холестерина, мочевой кислоты и креатинина.
- Анализ мочи. Обнаруживают проявления инфекций (лейкоциты и микроорганизмы в моче), а также признаки кровотечения.
- Пункция костного мозга. Выявляют замещение предшественников клеток крови на рубцовую или жировую ткань.
- Ультразвуковая диагностика. Позволят отследить поражение других органов.
- Электрокардиография. Диагностируют нарушение питания сердца и увеличенную частоту сокращений органа.
- Трепанобиопсия позволяет охарактеризовать состояние костного мозга.
 Трепанобиопсия — метод диагностики, позволяющий изучить костный мозг
Трепанобиопсия — метод диагностики, позволяющий изучить костный мозг
Показатели исследования крови и их расшифровка — таблица
| Общий анализ крови | Биохимический анализ крови |
|
|
Симптомы апластической анемии
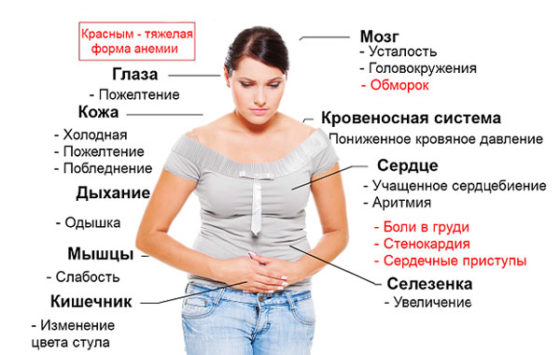
Заболевание обычно развивается остро. Ему свойственны следующие проявления:
- общая слабость;
- повышенная утомляемость;
- понижение работоспособности;
- бледность кожи и видимых слизистых;
- на слизистой ротовой полости образуются язвы, но они не вызывают болезненных ощущений;
- головокружение;
- головная боль;
- шум в ушах;
- покалывание в груди;
- одышка при малейшей физической нагрузке;
- сонливость;
- нарушение работы сердца, включая сердцебиение, тахикардию.
При апластической анемии удлиняется время свертывания крови, что провоцирует кровоизлияния в мягкие ткани и головной мозг. На этом фоне даже незначительное воздействие может спровоцировать синяки и кровоподтеки. Наблюдаются также носовые кровотечения, кровоточивость десен. Для женщин свойственны продолжительные и изнуряющие менструации.
На фоне апластической анемии организм становится подвержен различным инфекциям. В зоне риска находятся дыхательные пути, кожа, слизистые оболочки, мочевыводящие пути. Инфицирование сопровождается лихорадкой.
Течение болезни
Клиническое течение апластической анемии отличается по форме болезни.
Острая анемия
Острая форма заболевания протекает бурно, начинается резко с выраженного геморрагического синдрома (кровотечения разных видов). Присоединяется инфекция с высокой температурой (ангина, воспаление легких). Через несколько дней наступает крайняя степень опустошения костного мозга, угнетение эритроцитарного ростка. В крови обнаруживается относительный лимфоцитоз, значительное ускорение СОЭ. Летальный исход наступает через 1–1,5 месяца.
Подострая форма
Протекает менее быстро. Не слишком выражены геморрагии. Критические изменения крови наступают через 3 месяца или год.
Хроническая форма
Болезнь начинается постепенно и медленно прогрессирует. У человека появляется головокружение, бледность, непостоянные кровоподтеки. При осмотре не определяется увеличение селезенки. Возможна пальпация болезненных лимфоузлов. При правильном лечении удается приостановить процесс гибели костного мозга. Ремиссии длятся до нескольких лет. Обострение провоцируется любой инфекцией, стрессами.
Апластическая анемия – механизм развития
В настоящее время существует три теории, объясняющих механизм развития апластической анемии. Каждая из них получила подтверждение в ходе исследований.
Внимание. В некоторых случаях ни одна из имеющихся теорий не может объяснить возникновение заболевания
При таком варианте используют название «идиопатическая апластическая анемия».
Поэтому официально теории приняты, но изучение механизмов возникновения апластической анемии продолжается.
Теории патогенеза (возникновения) апластической анемии:
- аутоиммунная;
- стромальная;
- преждевременный апоптоз.
Аутоиммунная теория
Справочно. В аутоиммунной теории за основу берется развитие иммунного ответа к клеткам костного мозга.
Возникла она в результате исследования материала биоптата костного мозга после развития апластической анемии.
В большом количестве случаев ученые увидели присутствие клеточного иммунитета (моноциты, Т-киллеры), а также факторов воспаления – фактор некроза опухолей, интенферон альфа и гамма.
После более детального изучения стало понятно, что скапливаются они из-за генной мутации. В результате нарушения работы гена PIG-A возникает дефицит специального гликопротеина, который необходим для того, чтобы снижать активность системы комплемента, входящей в состав иммунной системы.
В результате этой поломки защита собственных клеток костного мозга слабеет, они начинают восприниматься, как чужеродные и развивается аутоиммунная реакция. В зависимости от количества поврежденных клеток степень выраженности симптомов разнится.
Важно. Чем больше вовлечено ткани, тем более агрессивная анемия наблюдается у пациента
Стромальная теория
Нормальное функционирование механизма кроветворения во многом зависит от стромы, то есть специального соединительнотканного основания, в котором находятся клетки костного мозга.
Строма отвечает за выработку специальных веществ (интерлейкины и факторы стволовых клеток), которые необходимы для направления недифференцированных молодых клеток по пути образования эритроцитов, тромбоцитов или лейкоцитов.
Стимулируется эта выработка эритропоэтином.
В случае нарушения выделения факторов роста на уровне стромы возникают низкодифференцированные клетки, которые не могут выполнять свои функции. Они не достигают дифференцировки, достаточной для определения в крови при анализе.
Справочно. Подтверждается данная теория при биопсии костного мозга – определяются предшественники клеток в большом количестве. А также определяется повышенный уровень эритропоэтина в крови. Такие изменения характерны не более чем для 20% случаев.
Теория преждевременного апоптоза
Термином апоптоз в медицине обозначают естественный процесс гибели клетки, когда она в полном объеме выполнила свою функцию. Происходит это во всех тканях организма. После определенного времени клетки подвергаются мутации, начинают восприниматься организмом, как старые, и удаляются.
В норме процесс представляет собой защитный механизм, который способствует обновлению тканей. Мутировавшие клетки могут переродиться в опухолевый процесс, и функция апоптоза – не допустить этого. Однако, если этот процесс начинает происходить раньше времени, возможно чрезмерное удаление клеток ткани. При недостаточном синтезе новых клеток этот процесс приводит к нарушению функции.
Справочно. Причиной слишком раннего удаления здоровых и молодых клеток является мутация гена, отвечающего за выработку протеина Р-450.
Изучение механизмов развития апластической анемии до сих пор является зоной научных интересов исследователей всего мира. Однако это может внести вклад в лечение заболевания в будущем, но никак не сказывается на современных пациентах.
Дело в том, что на сегодняшний момент самым эффективным методом лечения апластической анемии остается пересадка костного мозга. Для замедления процесса используют стероидные гормоны.
Внимание. Ни один из методов лечения не учитывает патогенез процесса
Классификация анемий
Анемии классифицируются:
- по механизму развития;
- по степени тяжести;
- по цветному показателю;
- по морфологическому признаку;
- по способности костного мозга к регенерации.
|
|
|
|
|
По механизму развития |
По патогенезу анемия может развиться вследствие кровопотери, нарушения образования эритроцитов или из-за их выраженного разрушения. |
По механизму развития выделяют:
|
|
По степени тяжести |
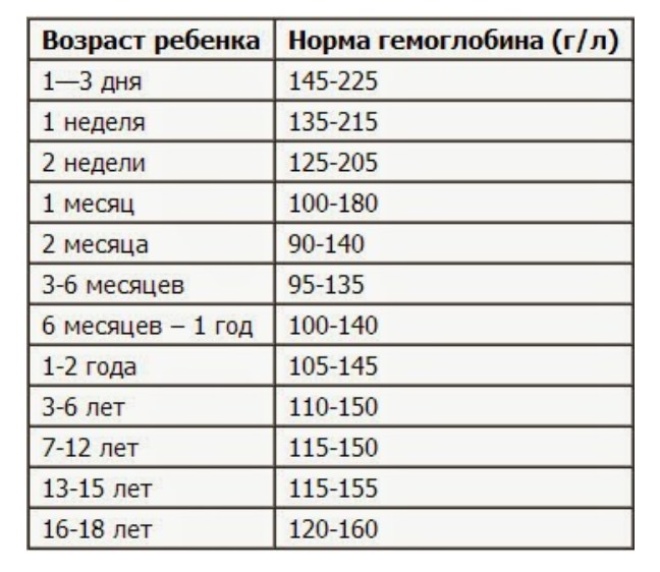
В зависимости от уровня снижения гемоглобина различают три степени тяжести течения анемии. В норме уровень гемоглобина у мужчин составляет 130 – 160 г/л, а у женщин 120 – 140 г/л. |
Существуют следующие степени тяжести анемии:
|
|
По цветному показателю |
Цветовой показатель — это степень насыщения эритроцитов гемоглобином. Рассчитывается он на основе результатов анализа крови следующим образом. Цифру три необходимо умножить на показатель гемоглобина и поделить на показатель эритроцитов (запятая убирается). |
Классификация анемий по цветному показателю:
|
|
По морфологическому признаку |
При анемиях во время исследования крови могут наблюдаться эритроциты различные по размеру. В норме диаметр эритроцитов должен составлять от 7,2 до 8,0 мкм (микрометр). Меньший размер эритроцитов (микроцитоз) может наблюдаться при железодефицитной анемии. Нормальный размер может присутствовать при постгеморрагической анемии. Больший размер (макроцитоз), в свою очередь, может указывать на анемии связанные с дефицитом витамина B12 или фолиевой кислоты. |
Классификация анемий по морфологическому признаку:
|
|
По способности костного мозга к регенерации |
Так как формирование эритроцитов происходит в красном костном мозге, то основным признаком регенерации костного мозга является увеличение уровня ретикулоцитов (предшественники эритроцитов) в крови. Также их уровень указывает на то, как активно протекает образование эритроцитов (эритропоэз). В норме в крови человека число ретикулоцитов не должно превышать 1,2% всех эритроцитов. |
По способности костного мозга к регенерации различают следующие формы:
|
Патогенез заболевания
Апластическая анемия вызвана подавлением процесса производства кровяных телец в костном мозге. Возможен повышенный уровень разрушения и уничтожения клеток собственными антигенами. Изучается механизм апоптоза (самопроизвольного уничтожающего процесса эритроцитов). Его приравнивают к «запрограммированному суициду». Установлена повышенная активность ферментов деструктивного действия в крови, дефицит нуклеиновых кислот.
Разрушение эритроцитов наблюдается внутри костного мозга на всех уровнях созревания. Снижается продолжительность жизни красных кровяных клеток.
Поскольку утилизация железа нарушается, излишки откладываются в печени и селезенке.
Образуется повышение уровня гормона эритропоэтина, но костный мозг не реагирует на его приказы.
Со снижением гранулоцитов блокируется их функция по участию в иммунной защите организма. Соответственное проявление сниженной свертываемости происходит из-за тромбоцитопенического синдрома.
Количество лимфоцитов увеличено. Костный мозг становится «пустым» (панмиелофтиз).
Апластическая анемия у детей
В детском возрасте чаще дебютируют врожденные типы апластических анемий, к которым относятся анемии Фанкони и Блекфена-Даймонда.
Анемия Фанкони представляет собой наследственную патологию, наследуемую по аутосомно-рецессивному типу, то есть случаи заболевания наблюдаются только в семьях, где оба родителя являются носителями патологического гена. Проявляется анемия Фанкони не только в глубоком угнетении всех типов кроветворения, но и в появлении аномалий развития.
Дебют заболевания приходится на возраст 4-12 лет, но гематологические проблемы могут возникнуть непосредственно после рождения ребенка. К врожденным аномалиям относятся: несоответствие костного возраста паспортному, врожденные пороки сердечно-сосудистой системы, микроцефалия, аномалии развития костной ткани, органов мочеполовой системы, отставание в психомоторном развитии. Гематологические изменения проявляются в более позднем возрасте (в среднем по достижению 9 лет) и в клинической картине преобладают симптомы геморрагического симптомокомплекса, после чего прогрессивно нарастают признаки лейкоцитопении и эритроцитопении.
Данная патология имеет стремительное прогрессирующее течение, поэтому при отсутствии адекватного лечения летальный исход наступает в течение 6 месяцев. Причиной смерти чаще всего является массивное желудочно-кишечное кровотечение или мозговое кровоизлияние. Осложнениями анемии Фанкони является трансформация заболевания в острый лейкоз, а также онкопатология органов желудочно-кишечного тракта. Единственным эффективным методом лечения врожденной анемии Фанкони является трансплантация костного мозга.
Анемия Блекфена-Даймонда относится к группе спорадических наследственных патологий крови и характеризуется поражением исключительно эритроцитарного ростка кроветворения. Дебют заболевания наблюдается в течение первого года жизни ребенка.
Дети с анемией Блекфена-Даймонда имеют типичный фенотип: бледные кожные покровы, крупная верхняя губа, широко поставленные глаза, сухие секущиеся волосы, отставание костного возраста от паспортного.
Характерным изменением лабораторных показателей периферической крови является прогрессирующая нормохромная анемия при полной сохранности пролиферации клеток тромбоцитарного и гранулоцитарного ряда.
Данная патология характеризуется вялотекущим хроническим течением со склонностью к спонтанной ремиссии. Предпочтительным методом лечения является применение кортикостероидной терапии, а также по жизненным показаниям переливание эритроцитарной массы.
В детском возрасте приобретенные формы апластической анемии встречаются крайне редко и проявляются теми же симптомами, что и у взрослых при полном отсутствии врожденных патологий.
При наличии у ребенка признаков нарушения кроветворной функции костного мозга обязательно необходимо проводить дифференциальную диагностику с такими заболеваниями как: острый лимфобластный и миелобластный лейкоз, мегалобластная анемия, синдром гиперспленизма, метастатическое поражение костного мозга.
Ребенок с подозрением на врожденную апластическую анемию обязательно подлежит комплексному обследованию, к которому относятся: цитогенетический анализ после трепанобиопсии, анализ крови на предмет наличия антител к клеткам крови, рентгенография с определением костного возраста, миелограмма. Также обследованию подлежат все ближайшие родственники больного ребенка.